|
NOVIDADES
Se há um material poluente, este é o plástico! Ele se degrada mal e, sobretudo, sua síntese química consome muita energia, libera dióxido de carbono (um gás de efeito estufa) e produz consideráveis quantidades de resíduos. Como parece muito difícil se livrar deste material, os químicos realizam pesquisas para torná-lo mais "verde". Yu Lei e seus colegas, do Laboratório Nacional de Argonne, nos Estados Unidos, propõem uma nova estratégia de síntese do óxido de propileno (um dos principais precursores do plástico), que libera pouco dióxido de carbono. Os plásticos são polímeros, isto é, agregados de múltiplas unidades orgânicas, denominadas monômeros. Um dos mais conhecidos é o poliuretano, um polímero de óxidos de propileno. A atual síntese industrial desses óxidos de propileno a partir de propileno (CH3-CH=CH2) faz intervir um intermediário de reação: a cloridrina. A oxidação realizada por este procedimento é eficaz: um átomo de oxigênio (O) se fixa sobre a dupla ligação do propileno para dar óxido de propileno, mas isso engendra a produção de resíduos clorados muitíssimo poluentes. Uma solução ecológica seria oxidar diretamente o polímero com oxigênio molecular (O2). O controle da reação e da execução desse tipo de síntese requer a presença de um catalisador, isto é, uma substância que facilite e acelere a reação. Os catalisadores utilizados para esse efeito frequentemente são metais, tal como a prata. Neste caso, a reação libera muito dióxido de carbono, e, pela óptica da produção industrial, ela não é suficientemente específica, porque a oxidação do propileno (adição do átomo de oxigênio) não se faz forçosamente sobre a dupla ligação, mas antes sobre o grupo metila (CH3). Os químicos americanos buscaram, por conseguinte, uma nova forma de catálise, para oxidar diretamente o propileno com o oxigênio molecular. Guiados por trabalhos anteriores, utilizaram seja agregados de três átomos de prata, seja de nanopartículas de prata (com tamanho médio de 3,5 nanômetros, formados por aglomerações de agregados Ag3, a temperaturas superiores a 110o C), depositados sobre um filme de alumínio. Os agregados ou as nanopartículas de prata têm elétrons livres não emparelhados (de spin resultante não nulo); seria graças a eles que os aglomerados de prata catalisam a reação de oxidação do propileno, liberando pouquíssimo dióxido de carbono e com uma seletividade importante em baixas temperaturas (cerca de 100o C). Desta maneira, obtém-se, principalmente, óxido de propileno com acréscimo de um átomo de oxigênio sobre a dupla ligação. Em futuro próximo, talvez seja possível utilizar industrialmente essa reação catalítica a fim de produzir plásticos, de modo mais ecológico. 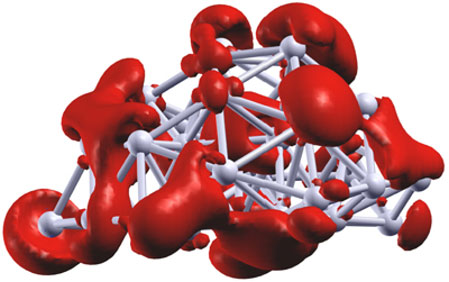 A ilustração representa a densidade (vermelho) dos spins eletrônicos em um agregado formado de 33 átomos de prata (cinza). Os cálculos indicam que é graças à presença de elétrons não emparelhados, portanto, aos spins eletrônicos, que os agregados de prata catalisam eficazmente a reação de oxidação do propileno em óxido de propileno (o que, em seguida, dará o plástico). Créditos: Science/AAAS. PourLaScience (Tradução - MIA). |
|||||||||||||||||||||||||