|
NOVIDADES
Sem as ligações de hidrogênio (também conhecidas como pontes de hidrogênio), a água e o DNA perderiam um bom número de suas propriedades. Químicos e biólogos não podem, pois, deixar de se interessar pela performance de uma equipe de pesquisadores chineses que trabalham na área de nanotecnologia. Eles acabam de observar, no microscópio de força atômica, ligações entre moléculas. Com este tipo de instrumento, esta é a primeira vez! Foi no início do Século XX que, vários químicos, mais ou menos independentemente, tomaram consciência que existia uma ligação química, à qual denominaram ligação hidrogênio. Frágil, ela é 20 vezes mais fraca que a ligação covalente (aquela que liga os átomos nas moléculas), porém mais forte que as ligações de van der Waals, inicialmente identificadas nos gases. Ela deve sua existência essencialmente às interações eletrostáticas de tipo dipolo-dipolo, mas há uma discussão sobre a contribuição dos efeitos quânticos, normalmente responsáveis pelas ligações covalentes. Ora, compreender melhor a ligação hidrogênio é um dos pontos de grande interesse, uma vez que se pode considerá-la como a ligação química da vida. De fato, ela atua na formação das estruturas tridimensionais das proteínas (sobretudo, das ligações entre as bases do DNA), mas é também responsável por muitas das propriedades singulares da água. Assim, próximo de 0 0C, a água se contrai quando aquecida e se torna mais fluida quando comprimida. Além disso, a água é um excelente solvente para sais, ácidos e bases por dissociar íons negativos e positivos. 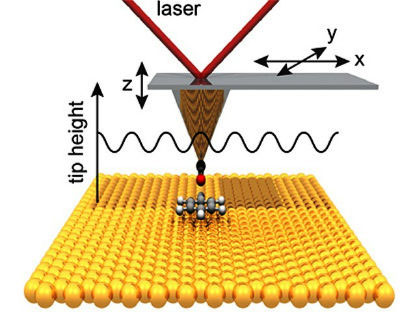 Princípio de uma medida no microscópio de força atômica em modo de ausência de contato (isto é, com uma molécula de monóxido de carbono na ponta da agulha do microscópio). É possível deduzir as variações de posição vertical, causadas pelas variações das forças exercidas pelos átomos. Destas variações, pode-se deduzir uma imagem, através de tratamento matemático. Créditos: UC Regents.
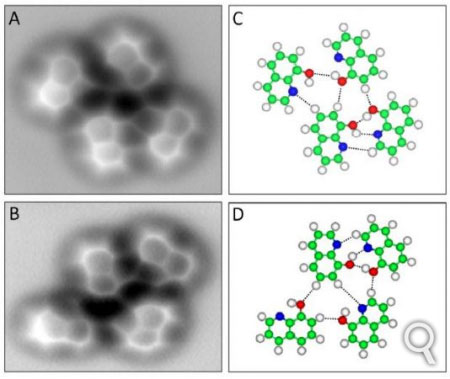 Moléculas de 8-hidroxiquinoleína. Nas imagens à direita: C (carbono) = verde; H (hidrogênio) = branco; O (oxigênio) = vermelho e N (nitrogênio) = azul. As ligações hidrogênio são representadas por pontilhados. Estas moléculas, sobre uma superfície de cobre, podem ser encontradas ligadas por ligações hidrogênio à baixa temperatura. É o que se constata nas duas imagens à esquerda, feitas com um microscópio de força atômica. Créditos: AAAS.
Futura Sciences (Tradução -MIA). Nota do Scientific Editor - O trabalho "Real-Space Identification of Intermolecular Bonding with Atomic Force Microscopy", que deu origem a esta notícia, é de autoria de Jun Zhang, Pengcheng Chen, Bingkai Yuan, Wei Ji, Zhihai Cheng e Xiaohui Qiu, tendo sido publicado na revista Science, on-line, 2013, DOI: 10.1126/science.1242603. |
|||||||||||||||||||||||||