|
NOVIDADES
Uma etapa importante no desenvolvimento de nanopartículas carregadas com agentes radioterapêuticos acaba de ser vencida por pesquisadores da Universidade de Rice (Houston), EUA. Os pesquisadores demonstraram a possibilidade de prender partículas alfa em nanotubos de carbono ultracurtos (20 a 50 nanômetros de comprimento). Os nanotubos de carbono possuem diversas propriedades interessantes, que os fazem bem adaptados para utilização em aplicações de tratamento do câncer: em particular, sua superfície pode, com facilidade, não apenas ser modificada quimicamente para torná-los biocompatíveis, mas também podem ser simultaneamente funcionalizados, para que possam se ligar seletivamente a uma espécie bioquímica. O interesse em se utilizar nanotubos ultracurtos, ao invés de nanotubos de carbono clássicos, vai na direção da possibilidade de penetração mais fácil nas paredes celulares e de se acumularem no interior das células. A preparação de nanotubos carregados com elementos radioativos é feita por imersão destes em uma solução de íons astatíneos (At) (elemento fortemente radiativo), a fim de colocar uma quantidade importante no interior do nanotubo. Todavia, os testes mostraram que somente cerca de 13,1% dos íons de At permaneceram presos após a operação.
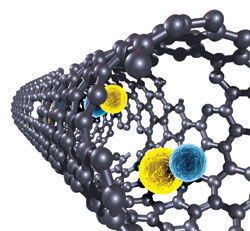 Nanotubo de carbono com o composto AtCl em seu interior. Créditos: Rice University
Visando medir as taxas de retenção in vitro destes compostos radioativos, os pesquisadores imergiram os nanotubos no serum sangüíneo e num tampão fosfato salino (PBS). As medidas revelaram taxas de retenção entre 85-93% e 72-85%, respectivamente. Tais taxas são, teoricamente, suficientemente elevadas para destruir eficazmente as células cancerosas. No futuro, os pesquisadores esperam testar a eficácia dos nanotubos radioativos in vivo, ligando em sua superfície anticorpos específicos que permitirão atingir, de forma seletiva, os tumores cancerígenos. Rice University (www.media.rice.edu/), consultado em 07 de outubro, 2007 (Tradução - OLA). Notas do Scientific Editor: (1) O nome vem do grego astatos (instável). Foi sintetizado pelo bombardeio de bismuto com partículas alfa, em 1940, por Corson, Mackenzie e Segre. Seu número atômico é 85 e seu peso atômico 210. Existem traços em isótopos naturais de urânio e tório e se estima que a quantidade total na crosta terrestre seja de apenas algumas dezenas de gramas. É um halogênio altamente radioativo e quimicamente se comporta como a maioria deles, em especial como o iodo (www.mspc.eng.br). (2) Dado ao fato do astatínio ser de ocorrência natural rara (menos que uma colher de chá em toda a crosta terrestre, até agora), as pesquisas da equipe de Rice foram conduzidas utilizando astatínio obtido artificialmente no ciclotron da Universidade de Washington (EUA). (3) Cloramina T, composto químico de fórmula molecular Na(CH3C6H4SO2NCl)·3H2O, normalmente usado como oxidante. (4) O trabalho que deu origem a esta notícia, intitulado "211AtCl@US-Tube Nanocapsules: A New Concept in Radiotherapeutic-Agent Design", de autoria de Keith B. Hartman, Donald K. Hamlin, D. Scott Wilbur e Lon J. Wilson, foi publicado na revista Small, volume 3, número 9, em 2007. |
|||||||||||||||||||||||||